Sialorrhée chez les patients avec la SLA : options de traitement actuelles
05-04-2019
(version abrégée)
Résumé :
 La Sclérose Latérale Amyotrophique (SLA) est un trouble neuro-dégénératif progressif du motoneurone, qui l’affecte sélectivement aussi bien sur le niveau central (premier motoneurone) comme sur le niveau périphérique (second motoneurone). La maladie se manifeste à l’âge moyen de 56 ans, et les mâles sont les plus affectés. Bien que la SLA puisse commencer comme une maladie bulbaire ou spinale, avec la progression de la maladie, toutes les deux deviennent typiquement évidentes. Les traitements pharmacologiques approuvés pour la SLA sont encore limités et incluent riluzole et edavarone, qui améliorent la survie dans le temps. Malgré ceci, la SLA mène à l’implication musculaire progressive et requiert une approche multidisciplinaire complexe pour contrôler l’invalidité croissante qui dépasse les motoneurones. La sialorrhée est, entre autres, un des symptômes les plus invalidants dans la SLA. La complexité à contrôler la salive est due à une spasticité musculaire et à un contrôle raréfié des muscles palatins-linguaux, plus tôt qu’à une surproduction de salive. Ces éléments pourraient accroitre le risque de pneumonie par aspiration et limiter l’emploi de ventilation mécanique non-invasive. Nous avons passé en revue les traitements de sialorrhée dans les patients SLA qui sont disponibles pour le moment, en faisant ressortir les pros et les contres pour chaque approche. Notre but est de créer un outil concret pour le diagnostic, afin de faciliter la quantification et le contrôle de la sialorrhée dans la pratique de tous les jours.
La Sclérose Latérale Amyotrophique (SLA) est un trouble neuro-dégénératif progressif du motoneurone, qui l’affecte sélectivement aussi bien sur le niveau central (premier motoneurone) comme sur le niveau périphérique (second motoneurone). La maladie se manifeste à l’âge moyen de 56 ans, et les mâles sont les plus affectés. Bien que la SLA puisse commencer comme une maladie bulbaire ou spinale, avec la progression de la maladie, toutes les deux deviennent typiquement évidentes. Les traitements pharmacologiques approuvés pour la SLA sont encore limités et incluent riluzole et edavarone, qui améliorent la survie dans le temps. Malgré ceci, la SLA mène à l’implication musculaire progressive et requiert une approche multidisciplinaire complexe pour contrôler l’invalidité croissante qui dépasse les motoneurones. La sialorrhée est, entre autres, un des symptômes les plus invalidants dans la SLA. La complexité à contrôler la salive est due à une spasticité musculaire et à un contrôle raréfié des muscles palatins-linguaux, plus tôt qu’à une surproduction de salive. Ces éléments pourraient accroitre le risque de pneumonie par aspiration et limiter l’emploi de ventilation mécanique non-invasive. Nous avons passé en revue les traitements de sialorrhée dans les patients SLA qui sont disponibles pour le moment, en faisant ressortir les pros et les contres pour chaque approche. Notre but est de créer un outil concret pour le diagnostic, afin de faciliter la quantification et le contrôle de la sialorrhée dans la pratique de tous les jours.
Recommandations :
1. La première approche thérapeutique de sialorrhée dans la SLA se fait avec l’amitriptyline, l’hyoscine orale ou transdermale, la scopolamine ou des gouttes sublinguales d’atropine ;
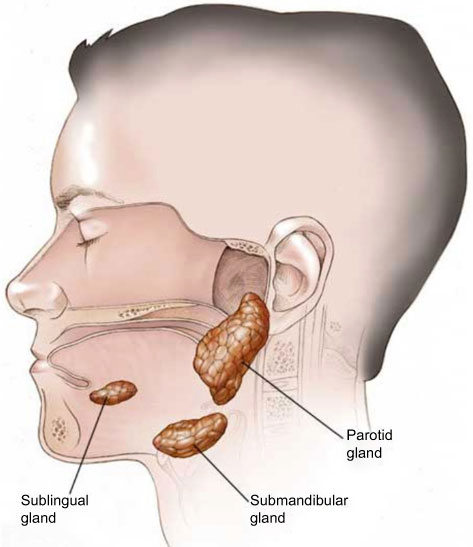
2. Les injections de toxine botulinique dans la parotide et/ou la glande sub-mandibulaire sont tolérées et efficaces quand elles sont injectées dans des patients avec une sialorrhée réfractaire.
3. Chez les patients SLA avec une sialorrhée conséquente, les injections de botuline dans la glande parotide réduisent la sialorrhée et améliorent la qualité de vie (QDV) jusque quatre mois, avec une efficacité à quatre semaines à partir de l’injection.
4. On suggère l’évitement d’injections directes de botuline dans les conduits salivaires à cause d’une association avec des effets nocifs signifiants.
5. Dans le cas d’un échec de traitement pharmacologique, on peut essayer l’irradiation des glandes salivaires.
6. La radiothérapie des glandes salivaires a montré son efficacité en réduisant la sialorrhée à des doses de 7 à 12,5 Gy jusqu’à six mois.
7. Les interventions chirurgicales ne sont pas recommandées dues à l’espérance de vie réduite des patients et l’incapacité de tolérer une intervention chirurgicale. Dans des cas sélectionnés, la chirurgie pourrait présenter un traitement alternatif parce que les avantages sont: pas de tachyphylaxie et pas de sessions thérapeutiques répétées.
8. Considérez la durée du traitement : Il y a une certaine évidence indiquant que la botuline comme la radiothérapie sont bien tolérées, des traitements effectifs pour une sialorrhée persistante chez les patients SLA et que la durée d’action va jusque trois mois pour la botuline et six mois pour la radiothérapie.
9. Discutez avec les patients des meilleures options de traitement.
Il y a différentes approches dans le timing du traitement : les directives EFNS commencent avec l’amitriptyline, suivie par l’hyoscine orale ou transdermale, ou les goutes sublinguales d’atropine, les injections de toxines botuliniques, utilisées dans les cas réfractaires. L’irradiation est considérée comme une option après un échec de traitement pharmacologique. Pour les patients avec des déficiences cognitives, les consignes NICE introduisent le glycopyrolate comme un traitement de première ligne à cause des moindres effets secondaires du système nerveux central.
Conclusion
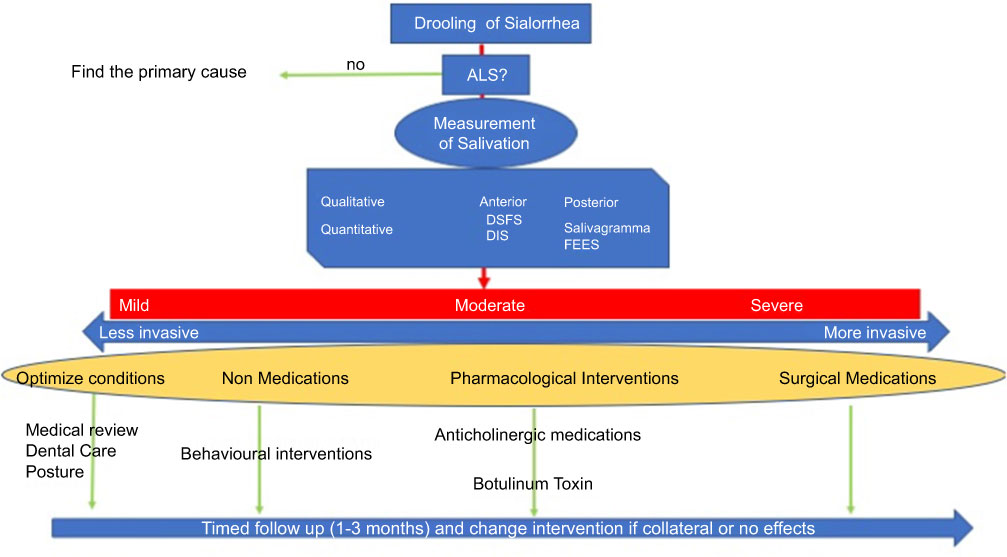
L’Évidence d’études précédentes est limitée et il y a encore un nombre de questions ouvertes. Comment pouvons-nous mesurer la sialorrhée de façon fiable et reproductive ? Comment pouvons-nous mesurer l’impact de ce symptôme spécifique dans la perception de qualité de vie des patients ? Quelle sera la durabilité du traitement ? Nous devrions considérer qu’il peut être nécessaire d’inclure des mesures, qui abordent spécifiquement l’impact d’écoulement de salive sur la qualité de vie, au lieu d’espérer de déterminer l’efficacité de mesurer l’impact sur la qualité de vie (QDV) globalement. En tout cas, des troubles quantitatifs et qualitatifs dans les sécrétions salivaires sont fréquents dans la pratique clinique et la sialorrhée est lourde à gérer pour les patients et les soignants. Actuellement, il y a un nombre de médicaments qui pourraient être, au moins partiellement, bénéfiques, mais les effets secondaires doivent être considérés. A cet égard, il est important que le traitement soit façonné en concordance avec la sévérité et l’impact sur la qualité de vie du patient, en équilibrant les effets secondaires. Nous croyons que l’approche pas-à-pas structurée décrite, peut s’avérer être un outil utile pour guider la pratique clinique et mieux cibler un traitement pour la sialorrhée dans la SLA (Figure 2).
Traduction : Gerda Eynatten-Bové
Source : Dove Press


